El sueño y la esperanza de una medicina personalizada a cada tipo de paciente está un poco más cerca con los avances que realiza la comunidad científica. Uno de esos grandes desarrollos está en los biomarcadores de imagen, una técnica relativamente nueva pero que está llamada a revolucionar tanto el diagnóstico de enfermedades (las biopsias podrían ser cosa del pasado con estas técnicas) como la evaluación de los tratamientos.
Ángel Alberich, reconocido como uno de los grandes innovadores menores de 35 años por la revista MIT Tecnology Review, está al frente de Quibim, una spin off del Instituto de Investigación Sanitaria La Fe de Valencia.
Este ingeniero de Telecomunicaciones y máster en Ingeniería Biomédica nos explica en qué consiste estos algoritmos que desarrolla y que permiten obtener diagnósticos más objetivos y precisos de ciertas enfermedades.

El reto de hacer objetiva la medicina con unos algoritmos
El reto es objetivar lo máximo posible el interior del cuerpo humano.
Así es.
¿Cómo se consigue? ¿Es un objetivo 100% realizable?
A día de hoy no. Lo que perseguimos es que el mundo de los biomarcadores de imagen se integre en la medicina.
Explícanos qué es un biomarcador.
Entendemos los biomarcadores de imágenes como cualquier medida que podemos extraer del interior de una persona a partir de sus imágenes médicas.
Esas imágenes, en nuestro caso, son radiológicas en su mayor parte. Es decir, trabajamos sobre imágenes de TAC, rayos X, resonancia magnética… y las diferentes variedades que se pueden encontrar en los hospitales.
Nuestro objetivo es poder, a partir de esas imágenes, analizar qué le sucede a los órganos utilizando los biomarcadores de imágenes; es decir, extrayendo mediciones del interior.
Estas mediciones pueden ser la sustancia gris de un paciente en el cerebro o la concentración de grasa que tiene el hígado. Logramos hacerlo sin la necesidad de hacer una biopsia. Es decir, utilizando únicamente las imágenes y las técnicas de análisis computacional y de los algoritmos matemáticos que utilizamos. Ése es nuestro propósito.
¿Por qué vuestro objetivo no se puede conseguir en la actualidad?
Para poder llegar a objetivar todo lo que sucede dentro del interior del cuerpo humano deberíamos ser capaces de ver a nivel de molécula o átomo. Eso, con las técnicas radiológicas actuales, no es posible, ni ver cuáles son los enlaces moleculares.
Quizá lo sea en un futuro, porque ahora hay técnicas moleculares de muy alta resolución (como el PET), pero no llegamos a ver las células de un sujeto vivo. Lo que vemos son píxeles. En ellos probablemente haya miles de células. Ahora vemos más los aspectos macroscópicos y no tenemos la imagen celular en un sujeto vivo.
Si tuviéramos ese microscopio en un sujeto vivo, sería fantástico. Pero a día de hoy no es posible.
Un algoritmo ayudando al médico
Tu trabajo es desarrollar algoritmos que evalúan estos marcadores de los que estamos hablando…
Tenemos muchos algoritmos que aplicamos dependiendo de la patología.
Por ejemplo, en una imagen donde se observa un hueso somos capaces de aplicar esos algoritmos para detectar la patología y la composición de los huesos. También se puede hacer el estudio del cartílago y ver si está dentro de lo normal o no.
Es decir, con la aplicación de estos algoritmos pasamos de la valoración cualitativa que hacía el médico (a partir de la observación y de sus ojos) a una cuantitativa.
Valoramos lo que realmente está pasando en el cuerpo humano a partir de las imágenes y de los datos. Normalmente, el radiólogo escribe en sus informes “se observa, se aprecia”. Lo que hacemos es pasar de esas apreciaciones a la cuantificación.

Muchas veces, en ciencia se trabaja por literatura científica basada en estudios. ¿Os basáis también en esa literatura a la hora de hacer esas comparaciones y los algoritmos?
Trabajamos en dos líneas. Una de ellas es en la que desarrollamos los biomarcadores. No hay que olvidar que nosotros somos investigadores y que Quibim es una spin off.
De hecho, vamos a publicar el primer libro que sale en el mundo de biomarcadores de imágenes. Es una metodología bastante nueva y ahora están saliendo las primeras asociaciones, como la European Imaging BioMarker Alliance, la Agencia Europea de Biomarcadores por imagen (ya existe la estadounidense), de la que tenemos el orgullo de formar parte.
Esto nos viene bien porque podemos integrar tanto métodos de análisis propios como los de otros investigadores y estamos actualizados conocimientos del estado del arte de los biomarcadores. Nuestros biomarcadores de análisis intentan integrar los más nuevos que van saliendo.
¿Qué pasa cuando no hay una imagen previa? ¿Se puede aplicar tu algoritmo?
Nuestros algoritmos no trabajan por comparación, trabajan cuantificando directamente propiedades.
Esto significa que podemos medir la concentración de hierro y de grasa en el tejido hepático (un sujeto normal no debería tener grasa en el hígado). Con los valores que obtenemos, ya somos capaces de decir si hay un 10% de grasa en el hígado y tantos miligramos de hierro por gramo de hígado. En ese punto es cuando estás dando valores. No necesitas ninguna comparación porque son medidas absolutas.
En el caso del pulmón hacemos algo parecido. Ante un enfisema pulmonar, a día de hoy el radiólogo mira el TAC y ve si es poco, moderado o severo. Lo que hacemos nosotros es pasar de esa valoración cualitativa a una objetiva, poniendo datos, diciendo tiene un enfisema de un 10% (cuando debe ser cero en condiciones normales).
¿Cómo se establecen estos valores de normalidad?
Están dentro de un rango. Tenemos nuestro grupo de validación de los biomarcadores de imagen. Cuando desarrollamos un nuevo biomarcador, lo evaluamos con voluntarios sanos, de tal forma que podemos tener una especie de valores de referencia.
Gracias a eso, cuando tenemos un paciente, somos capaces de comparar los valores de ese paciente contra la normalidad.
A mí me gusta comparar esta técnica con un análisis de sangre normal: los resultados finales de nuestro análisis se parecen mucho a los de un análisis de sangre, con la particularidad de que la muestra no es la sangre sino que es inmortal y digital: la imagen médica.
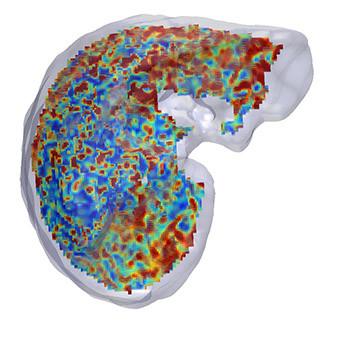
¿Cómo se puede, a través de una imagen radiológica, determinar la cantidad de grasa que hay en un hígado?
Tenemos que pensar que en las modalidades de imagen médica como la resonancia magnética o el TAC, cuando se generan las imágenes se procesan con un principio físico.
Por ejemplo, el TAC se centra mucho en los rayos X, que atraviesan el cuerpo.
Sabemos que los rayos X nos permiten estudiar la densidad y la cantidad de tejido duro que posee un cuerpo. Por eso, en los rayos X vemos muy bien los huesos, porque es un tejido muy organizado y compacto. Nosotros siempre vamos a estudiar el principio físico de la técnica.
En el caso de la resonancia, se caracteriza porque es muy sensible al hidrógeno (que está unido a otro tipo de moléculas). Conociendo eso, somos capaces —variando uno de los parámetros de la resonancia (cómo es el tiempo de eco)— de saber cuánta cantidad de agua y de grasa se está sumando y restando en cada imagen.
Al final lo que queda son comportamientos de la imagen frente a parámetros físicos. Nosotros podemos modelar estos comportamientos y resultados con técnicas matemáticas.
Para poder extraer esos componentes, pensamos en la técnica de imagen y en cuál es la más adecuada para poder calcular el biomarcador.
Intentamos entender al máximo cómo se refleja el principio físico de la técnica de imagen en la señal que luego veo. Estamos caracterizando los tejidos del cuerpo humano con un elevado nivel de detalle y de una manera no invasiva.
Es decir, que no es sólo para un mejor diagnóstico sino también para ver o mejor para diagnóstico de los tratamientos.
Exacto. Estamos en contacto con empresas farmacéuticas y haciendo pruebas con ellas, porque una de las ventajas de nuestra metodología es que somos capaces de objetivar esas respuestas al tratamiento y ver si está funcionando o no.
Esto les ahorra mucho tiempo a las empresas farmacéuticas en el desarrollo de los tratamientos, ya que ahora tienen que esperar a una segunda imagen radiológica.
Por ejemplo, en un tumor una de las pruebas más evidentes era la reducción del tamaño, pero había que esperar tres meses.
Ahora hay otros criterios, tenemos biomarcadores de angiogénesis (formación de vasos en el tumor) y, cuando se administra un tratamiento de quimioterapia, somos capaces de ver, a los pocos días, sí el mismo tumor ha variado de tamaño aunque tu ojo no lo perciba.
También podemos ver más características cuando cuantificas esos procesos de angiogénesis y extraes los biomarcadores.
Estamos trabajando para dar una respuesta muy rápida a la evaluación al tratamiento por parte de los pacientes.
¿Qué cambios puede conllevar esta innovación a la aplicación de la medicina?
Va a tener un impacto muy elevado en el diagnóstico, haciéndolo más objetivo y pasando de la percepción visual y de la experiencia del médico a tener un apoyo cuantitativo.
Tendremos un criterio objetivo con el que poder hacer un mejor diagnóstico. No tendremos una escala de grados ni grandes cajones de enfermedad en los que poner a cada uno de los pacientes, sino que cada uno tendrá su tratamiento personal, porque quizá un dato en el conjunto de datos clínicos tenga un impacto distinto en el diagnóstico que en un paciente que en otro.
Es un paso muy importante en el diagnóstico para la medicina personalizada.
Por otro lado, también impactará mucho en el tratamiento y su seguimiento, que será más objetivo.
Podremos cuantificar y medir exactamente si hay una enfermedad mínima residual o cambios que deben tenerse en cuenta y que se obvian por parte del ojo humano.
Un cambio que llegará en 10 años
¿Cuando tu innovación vas a ser algo tan común como una resonancia magnética?
Ahora mismo no.
Hace 10 años empezábamos a ver que la radiología iba a pasar de ser una valoración cualitativa únicamente para convertirse en una potentísima herramienta de medición. Con la digitalización de las imágenes nos dimos cuenta de todo ese proceso.
Hay una conciencia clínica de que la imagen médica puede dar mucho de sí.
Poco a poco se van integrando nuevos biomarcadores, pero creo que quedan todavía unos 10 años para que los sistemas de información de los hospitales, las bases de datos y los criterios de diagnósticos estén influenciados por los biomarcadores.
Ahora estamos haciendo todo ese trabajo. Los criterios clínicos todavía son los tradicionales, pero están saliendo todas las aplicaciones que van aportar la evidencia para que los biomarcadores de imagen, en un plazo de 10 años, estén en los informes clínicos y terapéuticos.
De hecho, hoy en día el 80% de las publicaciones de biomarcadores de imagen están relacionados con la medicina cuantitativa. Lo que aparece ahora en investigación, dentro de 10 años estará dentro de la red en muchos hospitales.
Hay muchos hospitales que ya apuestan por ello, y lo están integrando en sus procesos, como el Hospital La Fe de Valencia, abriendo esto a todo el mundo.
Nosotros somos una plataforma en la nube en la que cualquier centro en el mundo puede subir sus imágenes y recibir un análisis de esas imágenes. Se puede sacar esa información objetiva de un hígado, de un tumor, de los pulmones, el hueso, el cerebro… qué son las áreas que estamos potenciado en esta plataforma.
“España está a 10 años de distancia de EE. UU.”
¿A qué barreras te enfrentas para desarrollar tu innovación?
No me gusta pensar en barreras, porque siempre digo que las barreras las pone uno.
Es cierto que hay aspectos en los que es más difícil progresar, donde encontramos más retos que superar. Uno de ellos es el de la certificación.
Nosotros hemos medido y generamos medidas. Somos un instrumento de medición. Si queremos que la legislación nos vea como una medida de certificación —aunque seamos software— eso significa que debemos pasar toda la normativa de certificación como dispositivo médico, lo que no es un proceso simple.
Estoy muy de acuerdo en los procesos de certificación porque aportan garantías de que lo que se está utilizando está certificado, pero se requiere una mayor agilidad por parte de todos los organismos en la gestión de certificaciones. Hay diferentes organismos de estos procesos, como la Agencia Española del Medicamento, pero en todo este proceso regulatorio las pequeñas empresas como la nuestra pierde mucho tiempo. Lo ideal sería tener las certificaciones en 6 meses en lugar del año y medio o dos que tardamos ahora.
Por otro lado, otra de las barreras más importantes es la financiación en este país.
Nos hemos planteado incluso trasladar este proyecto a los Estados Unidos, porque hay empresas de ese país que nos darían todo el dinero… pero nos exigen que nos traslademos a Estados Unidos, donde todo es muy fácil.
En España es más complicado acceder a la financiación, aunque está progresando muy bien especialmente en Biotec. Pero estamos a 10 años de otros países como Estados Unidos. Si hubiéramos lanzado este proyecto en Reino Unido, Holanda o Estados Unidos, la velocidad que tendría sería mucho más rápida y mucho más alta.
Un producto sorprendente antes que una futura venta
¿Has recibido ofertas de otras empresas para integrar tu tecnología?
Estas integraciones no surgen de la noche a la mañana.
Existe mucho interés por parte de empresas tecnológicas y farmacéuticas, pero primero hay que estar en el mapa y eso significa muchos años de esfuerzo.
Nosotros empezamos hace 10 años a trabajar en esto. La empresa la fundamos en 2014. Hay que forjar relaciones a lo largo del camino.
Estamos muy bien relacionados con todas las tecnológicas y tenemos grandes relaciones con los grandes equipamientos de fabricantes de equipamiento tecnológico, de sistemas de almacenamiento de imagen, radiológicos en hospitales y con empresas del mundo de los ensayos clínicos.
A pesar de que algunas de ellas se ofrecen para hacer alianzas tecnológicas, nosotros hemos elegido un camino en el que hemos ido desarrollando el producto para hacerlo cada vez más atractivo. El objetivo es tener una versión mejorada de este producto, seguir ofreciéndolo.
Quién sabe si este producto o estas plataformas de biomarcadores de imágenes dentro de X años puede ser de su interés. No descartamos su venta. Pero hoy en día estamos creciendo y valorando con mucho cuidado nuestras alianzas, porque estamos muy enfocados en nuestro trabajo diario.
Lanzamos la plataforma en la nube en marzo del año pasado y hemos tenido muchos comentarios de nuestros usuarios y los clientes nos han aportado muchísimo.
Estamos en un día a día frenético, de ir añadiendo pequeñas mejoras, que añadan mucho valor y incorporando nuevos biomarcadores.
Vamos a cerrar una ronda de financiación. Vienen unos tiempos muy apasionantes para Quibim y eso nos va a poner aún más en el mapa. También va a salir publicado a nivel mundial el libro de biomarcadores, en el que participamos.
Creo que los próximos dos años van a ser muy buenos para situar a la empresa en el punto que tú comentabas, de que pueda suscitar el interés de alguna grande. Pero no es algo que nos preocupe.
Nuestro objetivo es tener un producto que realmente despierte el interés, que cualquiera que vea una demo de nuestro producto diga “guau”. Es lo que más nos hace felices ahora.